陽電子断層撮像(PET)による画像診断や臨床研究の発展は、その基礎となる放射性薬剤の開発に大きく依存しています。PETの研究と言うと、一般的には、疑似カラー表示の華々しい画像を思い浮かべると思いますが、実際にその画像が出るまでには、それを下支えしている多くの研究者や技術者の努力の結晶の賜物であることは、あまり理解されていません。ここでは、普段あまり目にする事のない、PET検査で使用する薬剤の製造について解説したいと思います。
PETによる画像診断は、核医学診断法の一つで、陽電子(ポジトロン)を放出する放射性同位元素で標識した薬剤を生体に投与し、放射能の分布や時間経過を体外からPETカメラを用いて撮影する検査です。したがって、生体に投与する放射性薬剤の種類を変えることによって、様々な病気の診断や生体機能の計測に応用することができます。たとえば、現在、最も広く利用されているPET薬剤の[18F]FDGは、ブドウ糖によく似た物質をポジトロン核種の18Fで標識した放射性薬剤で、糖代謝が盛んな部位に多く集まることから、悪性腫瘍やブドウ糖をエネルギー源とする脳の神経活動の評価に使われています。他にも、脳の神経受容体を計測する放射性薬剤やアルツハイマー型認知症で蓄積が認められるアミロイドベータたんぱく質を検出する放射性薬剤などが臨床応用されています。
現在、臨床利用されている主なポジトロン核種は、18F、11C、13N、15Oの4種類で(表1)、これらは生体内の生理活性物質や医薬品の構成元素そのものの放射性同位体であるため、構造を変化させることなく多種多様な標識化合物を得ることができます。18Fは他のポジトロン4核種に比べて半減期(放射能が半分に減る時間)が109.8分と長いことから、比較的複雑な合成が可能で、商業的な供給も可能です。11Cは、有機化合物の基本骨格である炭素の放射性同位体であるため、標識対象の化合物は限りがなく、これまでに最も多くの化合物が開発されています。13Nは半減期が10分と短寿命であるため、薬剤合成は検査ごとに行われます。現在、ポジトロン放射性医薬品として、心筋血流イメージング剤13N-アンモニアが保険適応され利用されています。15Oは、半減期が2分と極めて短いため、薬剤合成は核種製造後、PET検査室への供給過程でオンライン的に行われます。現在、酸素(15O-O2)、一酸化炭素(15O-CO)、二酸化炭素(15O-CO2)のガス剤および水(15O-H2O)が臨床利用されており、このうちガス剤の3種類が保険適応されています。
これらの核種の半減期は極めて短いため、核種や放射性薬剤の製造には、サイクロトロンなどの加速器(図1)や薬剤合成装置(図2)、これに付随する設備や人員を自前で揃える必要があります。また、ポジトロン核種は比放射能(物質の量に対する放射能の割合)が極めて高いため、通常の検査で人体に投与される薬物量は数マイクログラム以下であり、安全性が高く、超短半減期核種であることから、被験者の放射線被ばくも低い特徴があります。比放射能が高い利点として、他には、体内に微量にしか存在しない神経伝達物質や受容体などの画像診断が可能となることや、投与薬物量が薬理作用を発現する物質量より極めて少なくなるため、新規医薬品開発における臨床前段階のスクリーニン試験(PETマイクロドーズ試験)としても活用されています。
表1. PETに用いられる主なポジトロン核種の製造法
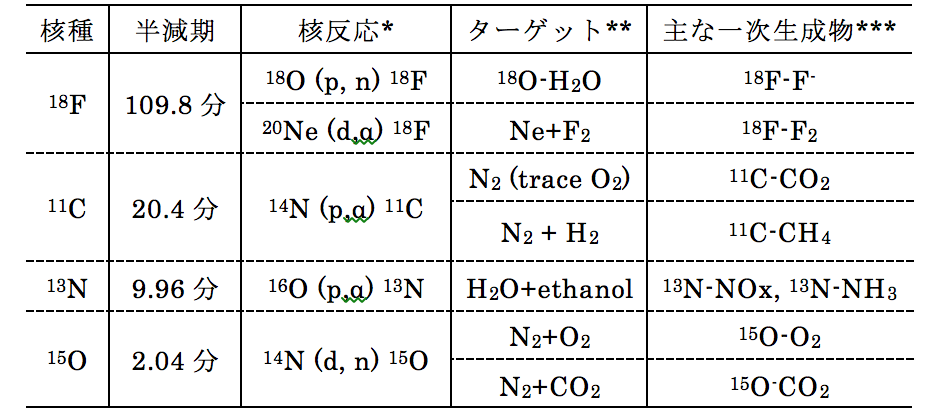
*核反応:ある元素の原子核に粒子が入射して、1つ以上の粒子を放出して他の元素となること。18O(p, n)18F は原子番号(=陽子数)8で質量数(陽子数+中性子数)が18の酸素の同位体18Oの原子核に陽子(p)が1つ入射して、中性子(n)を1つ放出することにより、原子番号9で質量数が18のフッ素の同位体18Fとなることを表している。
**核反応による入射粒子の標的となる元素
***ターゲット内のホットアトム反応から得られる生成物
図1.ポジトロン核種の製造に用いられるサイクロトロン

図2.PET薬剤の製造に用いられる自動合成装置とホットセル

ポジトロンで標識された放射性薬剤(PET薬剤)の製造は、加速器による核種製造、標識合成および精製、注射剤などへの調製が迅速に行われます。放射性薬剤の製造は、昔から「時間との闘い」と言われています。特に標識合成では、多くの合成ステップや長時間の反応を用いることはできないため、放射能の減衰と化学反応収率を考慮に入れながら、反応速度が速く、かつ高い放射化学的収率が望める反応を選択します。
標識反応は、合成の最終段階で行われ、ターゲット内でのホットアトム反応(核反応で生成した核種が持つ反跳エネルギーを利用する反応)から得られる一次生成物(表1)、もしくはこれらを原料として反応性を高めた標識試薬を用います。標識合成後は、ほとんどの場合で反応副生成物や非放射性の不純物が含まれるため、高速液体クロマトグラフィ法もしくは固相抽出法で分離精製を行ないます。これらの操作では、溶媒に有機溶媒が使用されることが多いため、最終製剤は溶媒を減圧留去あるいは固相抽出により精製したのち、注射用生理食塩水などで再溶解して使用します。
一連のPET薬剤製造では、大量の放射能が取り扱われるため、作業者の被ばく防止、製剤の安定供給、作業の省力化などの観点から、合成は遠隔操作が可能な標識化合物自動合成装置を用いて、鉛で遮蔽されたホットセル内で行われます。 PET薬剤は、一部のガス剤を除き、静脈用注射剤の形で供給されます。したがって、薬剤の製造は無菌的に行われなければなりません。放射性薬剤は名前のとおり、放射性物質としての側面と医薬品としての側面があり、それぞれ相反する考え方や規制があります。また、PET薬剤は、超短半減期のため、無菌試験の結果を待って投与することができません。これらの問題点に対しては、厳密な差圧管理やパラメトリックリリース(無菌試験の結果によらず、プロセスパラメーターがあらかじめ定められた許容範囲内に与えられたことを証明する記録に基づいて無菌性を保障する)といった考え方を導入するなどの工夫をして解決しています。
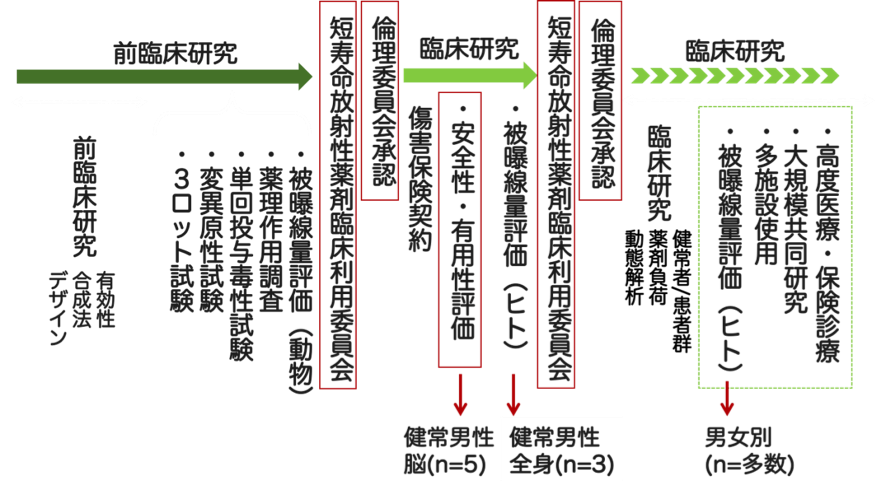
神経画像研究チームでは、1990年に設立された旧ポジトロン医学研究施設も含めるとこれまでに48種類の放射性薬剤の臨床使用承認を得てきました。これらの中には世界で初めてヒトに投与された9化合物も含まれています(図3)。これらの新規薬剤は、施設ごとに定めたルール・プロセスを経て臨床使用されるに至ります(図4)。
まず、開発候補化合物を見出す必要があります。この段階では、薬剤のデザインや合成法の検討、有効性の評価を行います。次に、臨床使用が期待できる候補化合物が見出されたとします。ここで言う「臨床使用が期待される」というのは、目的とする生体機能がPETで計測できるという観点になります。候補化合物の3ロット製造試験を実施し、品質と製造量に関して規格を満たすかを確認します。また、薬物としての安全性と注射薬としての安全性に関する試験を実施します。基本的には、変異原性試験と単回投与毒性試験になりますが、化合物のプロファイルに応じて薬理作用を調査する場合もあります。例えば、アゴニストできわめて強い薬理活性を持つような化合物がこれにあたります。これらの安全性の評価に加えてマウス体内分布試験から推定する被ばく線量評価と合わせて、短寿命放射性薬剤に関する専門委員会でPET薬剤の有効性と安全性を審議して、承認となった場合には、倫理審査委員会で、初期臨床試験のプロトコール審査をします。我々の施設では、2000年に定めた自主基準にしたがって、新規PET薬剤の場合、5名の健常成人男性で安全性と有効性を評価した後、3名の健常成人男性で内部被ばく線量評価を行うことによって、有効性や安全性のないPET薬剤を漫然と使い続けることがないようにしています。この初期試験の結果にて有効性と安全性が認められた場合には、新たに次の段階のプロトコールを倫理審査委員会で審議し、その先の臨床研究に進む仕組みとなっています。
図3.当センターで開発され世界で初めて臨床使用されたPET薬剤
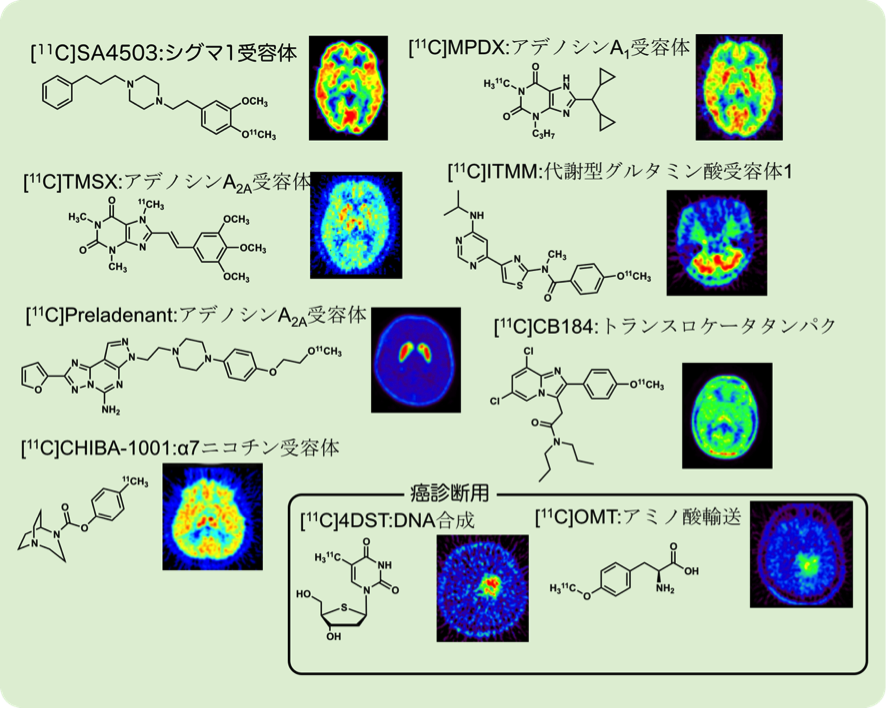
図4. 新しいPET薬剤の臨床使用までの道のり
これまで話してきた病院内や研究所で製造される放射性薬剤の製造は、院内製造としての扱いになり、PET薬剤について規制当局からこれまで明確な基準は示されてきませんでした。すなわち、PET薬剤の製造は、それぞれの製造施設において、医療法に基づき、施設ごとに実施されているため、製造方法や品質管理の規準は各施設に一任され、標準化されていませんでした。これに対して、2011年に日本核医学会を中心に、院内製造の品質保証レベルの向上および製造方法や品質管理の標準化を目的として、PET薬剤製造施設の学会認証システムが導入されました。当センターでは、これに対応し2014年に学会製造施設認証を取得しています。一方、PET先進国といわれている米国では院内製造に対して、GMP要件を課しており、当センターにおいても国際的な共同研究やグローバル治験に参入するため、薬機法(治験薬GMP)下でのポジトロン放射性薬剤の製造を可能としました。今後、製薬企業においてポジトロン放射性薬剤を用いたPET臨床試験(治験)はますます増加すると予想され、研究の成果を社会に還元する役割としての期待に応えていきたいと感じています。