メンバー
| リーダー |
研究部長 三浦 ゆり |
|---|
| 研究員 |
津元 裕樹、梅澤 啓太郎、川上 恭司郎 |
|---|
キーワード
プロテオーム、プロテオミクス、グライコミクス、グライコプロテオミクス、超硫黄、エクソソーム、酸化ストレス、翻訳後修飾、健康長寿、バイオマーカータンパク質
主な研究
- 老化関連疾患に関わるタンパク質翻訳後修飾のプロテオーム解析
- 健康長寿に関わるタンパク質のプロテオーム解析
- 疾患バイオマーカーのプロテオーム解析
研究紹介
私たちの体は、2万余りの遺伝子(ゲノム) の情報に基づいて作られた10万種類以上のタンパク質の集まり(プロテオーム) によって構成され、それらの機能によって生命が維持され、健康が保たれています。
老化したり病気になったりして組織や細胞の機能が損なわれると、タンパク質に変化が起きます。つまり、タンパク質の変化を調べることで、病気や病態の指標となるタンパク質(バイオマーカータンパク質)や病気の原因に関わるタンパク質などを明らかにすることができるのです。そこで私たちは、図のようなプロテオーム解析の手法を用いて、老化に伴っておきる疾患でのタンパク質の変化から、老化や老化関連疾患の病態を解明したり、バイオマーカーを探索する研究に取り組んでいます。
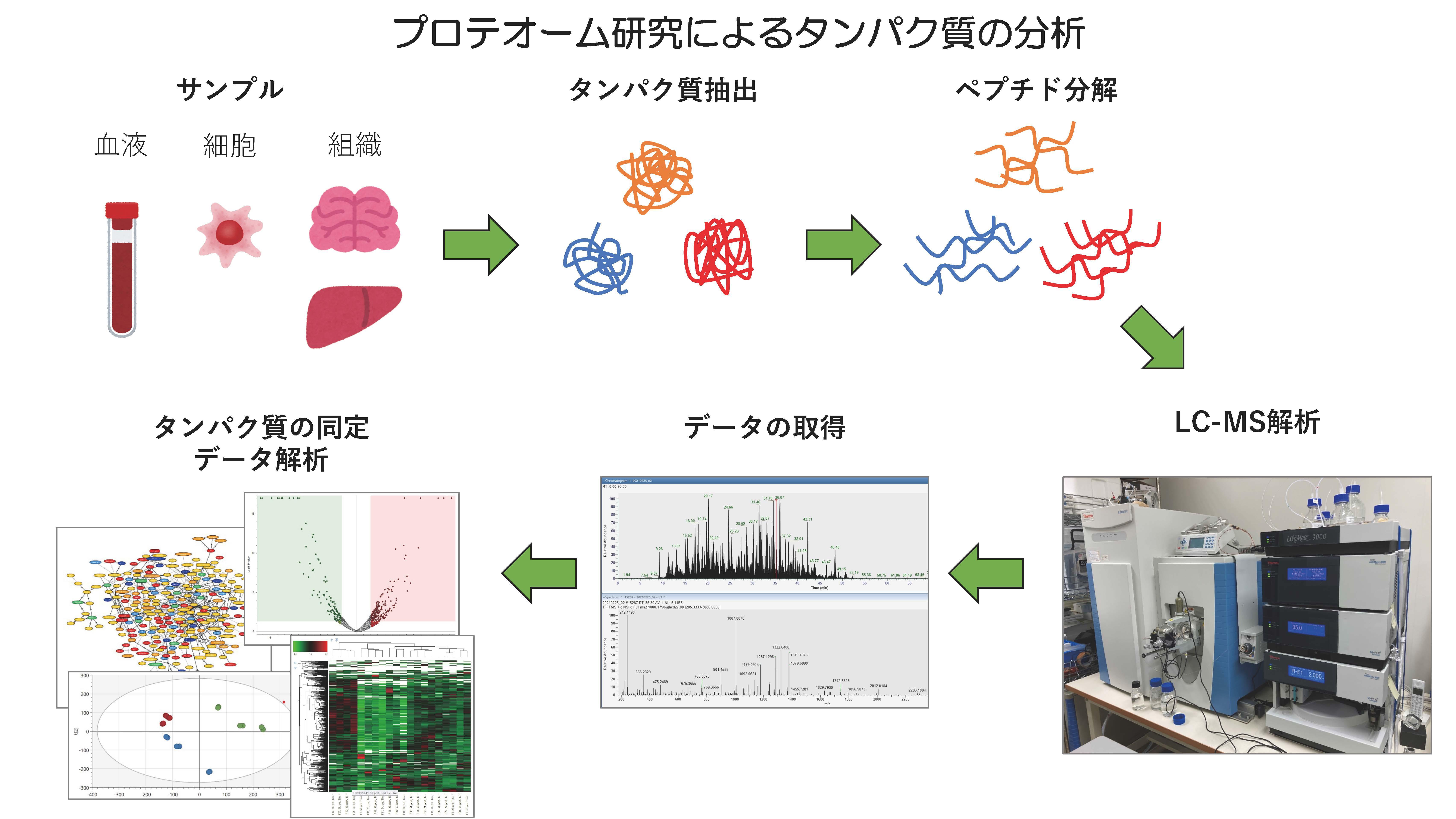
1.老化関連疾患に関わるタンパク質翻訳後修飾のプロテオーム解析
タンパク質は合成された後、様々な修飾(翻訳後修飾)を受けることが知られています。私たちは、タンパク質が修飾を受けることによって、活性化や細胞内での局在化、タンパク質同士の相互作用、さらに失活や分解など、その様々な機能が制御されることに着目しました。そこで、糖尿病などの老化関連疾患において、タンパク質の修飾がどのように変化するかをプロテオーム解析によって明らかにし、疾患や病態のバイオマーカーとなる修飾タンパク質を探索しています。
2.健康長寿に関わるタンパク質のプロテオーム解析
105歳以上の超百寿者の血漿タンパク質のプロテオーム解析やグライコミクス、グライコプロテオミクス解析から健康長寿マーカーとなるタンパク質を探索しています。
3.疾患バイオマーカーのプロテオーム解析
血管老化などの老化関連疾患において特異的に変動するタンパク質を調べ、疾患バイオマーカーや病態解明につながるタンパク質を探索しています。
主要文献
- Shiiba, I., Ito, N., Oshio, H., Ishikawa, Y., Nagao, T., Shimura, H., Oh, K. W., Takasaki, E., Yamaguchi, F., Konagaya, R., Kadowaki, H., Nishitoh, H., Tanzawa, T., Nagashima, S., Sugiura, A., Fujikawa, Y., Umezawa, K., Tamura, Y., Lee, B., Hirabayashi, Y., Okazaki, Y., Sawa, T., Inatome, R., Yanagi, S.: ER-mitochondria contacts mediate lipid radical transfer via RMDN3/PTPIP51 phosphorylation to reduce mitochondrial oxidative stress. Nature Communications, 2025, 16, 1508.
- Nishimura, A., Ogata, S., Tang, X., Hengphasatporn, K., Umezawa, K., Sanbo, M., Hirabayashi, M., Kato, Y., Ibuki, Y., Kumagai, Y., Kobayashi, K., Kanda, Y., Urano, Y., Shigeta, Y., Akaike, T., Nishida, M.: Polysulfur-based bulking of dynamin-related protein 1 prevents ischemic sulfide catabolism and heart failure in mice. Nature Communications, 2025, 16, 276.
- Nishimura, A., Tanaka, T., Shimoda, K., Ida, T., Sasaki, S., Umezawa, K., Imamura, H., Urano, Y., Ichinose, F., Kaneko, T., Akaike, T., Nishida, M.: Non-thermal atmospheric pressure plasma-irradiated cysteine protects cardiac ischemia/reperfusion injury by preserving supersulfides, Redox Biology, 2024, 79, 103445.
- Ebina, M., Miura, Y., Sakane, F.: Ubiquitin-specific peptidase 11 selectively interacts with and deubiquitination-dependently stabilizes diacylglycerol kinase d to maintain cellular glucose uptake, Biochim. Biophys. Acta Mol. Cell Res., 2024,1872, 119883.
- Wu, T., Sun, Y., Wang, D., Isaji, T., Fukuda, T., Suzuki, C., Hanamatsu, H., Nishikaze, T., Tsumoto, H., Miura, Y., Furukawa, J., Gu, J.: The acetylglucosaminyltransferase GnT-Ⅲ regulates erythroid differentiation through ERK/MAPK signaling, J. Biol. Chem., 2024, 300, 108010.
- Yoshida, Y., Ishizaki, T. Masui, M., Miura, Y., Matsumoto, K., Nakagawa, T., Inagaki, H., Ito, K., Arai, Y., Kabayama, M., Kamide, K., Rakugi, H., Ikebe, K., Gondo, Y.: Effects of multimorbidity and polypharmacy on physical function in community-dwelling older adults: a 3-year follow-up analysis of the SONIC study, Arch. Gerontol. Geriatr. 2024, 126, 105521.
- Imae, R., Manya, H., Tsumoto, H., Umezawa, K., Miura, Y., and Endo, T.: Changes in the amount of nucleotide sugars in aged mouse tissues, Glycobiology, 2024, 34, cwae032.
- Zhang, Z., Aoki,H., Umezawa,K., Kranrod, J., Miyazaki, N., Oshima,T., Hirao, T., Miura, Y., Ito, K., Aoki, S: Potential role of lipophagy impairment for anticancer effects of glycolysis-suppressed pancreatic ductal adenocarcinoma cells, Cell Death Discov., 2024, 10, 166.
- Kato, Y., Byeon, J., Noto, A. Kashiwaya, S., Aoki, Y., Watanabe, N., Tsumoto, H., Miura, Y., Fukui, K.: Tocotrienols prevent the decline of learning ability in high-fat high-sucrose diet-fed C57BL/6 mice, Int. J. Mol. Sci., 2024, 25, 3561.
- Kondo, M., Nakamura, Y., Kato, Y., Nishimura, A., Fukata, M., Moriyama, S., Ito, T., Umezawa, K., Urano, Y., Akaike, T., Akashi, K., Kanda, Y., Nishida, M.: Inorganic sulfides prevent osimertinib-induced mitochondrial dysfunction in human iPS cell-derived cardiomyocytes, J. Pharmacol. Sci. 2024, 156, 69-76.
- Zhou, L., Nishimura, A., Umezawa, K., Kato, Y., Mi, X., Ito, T., Urano, Y., Akaike, T., Nishida, M.: Supersulfide catabolism participates in maladaptive remodeling of cardiac cells. J. Pharmacol. Sci. 2024, 155, 121-130.
- Ogawa, Y., Miura, Y., Ikemoto, M., Ohnishi, A., Goto, Y., Aoki, K., Motokurumada, Y., Akimoto, Y., Endo, T., Tsujimoto, M., Yanoshita, R.: Distinguishing two distinct types of salivary extracellular vesicles: A potential tool for 5 understanding their pathophysiological roles, Front. Mol. Biosci. 2024, 11, 1278955.
- Fujita, Y., Shinkai, S., Taniguchi. Y., Miura, Y., Tanaka, M., Ohsawa, I., Kitamura, A., Ito, M.: Association between serum GDF15 concentration and total mortality in community-dwelling Japanese older populations: The involvement of renal dysfunction, J. Gerontol. A Biol. Sci. Med. Sci. 2023, 78, 1701-1707.
- Miura, Y., Tsumoto, H., Masui, Y., Inagaki, H., Ogawa, M., Ideno, Y., Kawakami, K., Umezawa, K., Kabayama, M., Akagi, Y., Akasaka, H., Yamamoto, K., Rakugi, H., Ishizaki, T., Arai, Y., Ikebe, K., Kamide, K., Gondo, Y., Endo, T.: A characteristic N-glycopeptide signature associated with diabetic cognitive impairment identified in a longitudinal cohort study, Biochim. Biophys. Acta Gen. Sub., 2023, 1867, 130318.
- Yachida, N., Hoshino, F.,Murakami, C., Ebina, M., Miura, Y., Sakane, F.: Saturated fatty acid- and/or monounsaturated fatty acid-containing phosphatidic acids selectively interact with heat shock protein 27, J. Biol. Chem. 2023, 299, 103019.
- Umezawa, K., Tsumoto, H., Kawakami, K.,Miura, Y.:A chemical probe for proteomic analysis and visualization of intracellular localization of lysine-succinylated proteins, Analyst, 2023, 148, 95-104.
- Mori, S., Suzuki, S., Konishi, T., Kawaguchi, N., Kishi, M., Kuwabara, S., Ishizuchi, K., Zhou, H., Shibasaki, F., Tsumoto, H., Omura, T., Miura, Y., Mori, S., Higashihara, M., Murayama, S. Shigemoto, K.: Proteolytic ectodomain shedding of muscle-specific tyrosine kinase in myasthenia gravis, Exp. Neurol., 2022, 361, 114300.
- Ueda, Y., Miura, Y., Tomishige, N., Sugimoto, N., Murase, M., Kawamura, G., Sasaki, N., Ishiwata, T., Ozawa., T.: Mechanistic insights into cancer drug resistance through optogenetic PI3K signaling hyperactivation, Cell Chem. Biol. 29, 2022, 1576-1587.
- Mizutani, K., Kawakami, K., Fujita, Y., Kato, T., Takai, M., Kato, D., Iinuma, K., Koie, T., Ito, M.: Gene therapy of prostate cancer using liposomes containing perforin expression vector driven by the promoter of prostate-specific antigen gene, Scientific Reports, 2022, 12, 1442.
- Kawakami, K., Fujita, Y., Kato, T., Horie, K., Koie, T., Umezawa, K., Tsumoto, H., Miura, Y., Katagiri, Y., Miyazaki, T., Ohsawa, I., Mizutani, K., Ito, M.: Diagnostic potential of serum extracellular vesicles expressing prostate-specific membrane antigen in urologic malignancies, Scientific Reports, 2021, 11, 15000.
- Imae, R., Manya, H., Tsumoto, H., Miura, Y., Endo, T.: PCYT2 synthesizes CDP-glycerol in mammals and reduced PCYT2 enhances the expression of functionally glycosylated α-dystroglycan, J. Biochem. 2021, 170,183-194.
- Sato, M., Tsumoto, H., Toba, A., Soejima, Y., Arai, T., Harada, K., Miura, Y., Sawabe, M.: Proteome analysis demonstrates involvement of endoplasmic reticulum stress response in human myocardium with subclinical left ventricular diastolic dysfunction, Geriatr. Gerontol. Int. 2021, 21, 577-583.
- Hishida, S., Kawakami, K., Fujita, Y., Kato, T., Takai, M., Iinuma, K., Nakane, K., Tsuchiya, T., Koie, T., Miura, Y., Ito, M., Mizutani, K.: Proteomic analysis of extracellular vesicles identified PI3K pathway as a potential therapeutic target for cabazitaxel-resistant prostate cancer, The Prostate, 2021, 81, 592-602.
- Iinuma, K., Kawakami, K., Mizutani, K., Fujita, Y., Yamaguchi, T., Ito, M., Kumano, T., Matsuo, M., Nakano, M., Koie, T., Ito, M., Kato, T. miRNA-93 in Serum Extracellular Vesicles Before and After Low Dose Rate Prostate Brachytherapy, Anticancer Res., 2021, 41, 2411-2418.
- Takai, M., Kawakami, K., Fujita, Y., Kato, T., Kato, D., Iinuma, K., Koie, T., Ito, M., Mizutani, K.: Kartogenin Inhibits Prostate Cancer Cell Growth Through Smad2 Activation and Decreases Androgen Receptor Nuclear Localization, Anticancer Research, 2021, 41, 4753-4759.
