メンバー
| リーダー |
研究副部長 豊田 雅士 |
|---|
| 研究員 |
佐々木 紀彦、板倉 陽子、大瀬 賢介(認知症未来社会創造センター) |
|---|
| 非常勤研究員 |
吉田 友里香 |
|---|
| 研究生 |
大学院生1名 |
|---|
キーワード
心血管病、老化、血管、糖鎖、組織再生、幹細胞
主な研究
- 血管の老化と疾患に関する研究
- 心臓の老化・疾患発症と組織機能再生に関する研究
- 幹細胞研究・ヒト老化モデル構築と再生医療に向けた基礎研究
研究紹介
高齢者の増加に伴う心不全や呼吸不全患者の急増で、今後懸念される「心不全・呼吸器不全パンデミック」に対処するための基礎研究に取り組んでいます。
生体内の組織は、加齢に伴って機能が低下する「老化」が起こります。この過程で、私たちのからだが健康に維持される場合もあれば、疾患につながってしまう場合もあります。ではその分岐点はどこにあるのでしょうか。私たちは、心臓血管系に関してその疑問に答えるべく研究に取り組んでいます。1つの視点として「構造の乱れが機能低下の起点になる」と考え、生命を支え続ける機能を持つ心臓の緻密構造が、いつ、どこで、どのように変化しているかを、血管、心筋細胞などの形態や細胞間結合・接着など組織学的な側面から追跡し、その変化がどのような機能変化をもたらすかを探求しています。また低下してしまった機能を再生させる試みもしています。
「健康」と「疾患」の分岐点を捉えることによって、心機能の低下を早期に見出すことで適切な診断・治療、また高齢者の生活の質を確保した負担のかからない新たな再生医療へとつがることを目指しています。
1.血管の老化と疾患に関する研究
全身に張り巡らされた血管は、組織に酸素や栄養を供給し機能維持に重要な役割を果たしています。「ヒトは血管とともに老いる」と言われ、組織機能の低下が血管機能に深く関与していると考えられますが、その詳細な機序についてはよくわかっていません。私たちは、血管の加齢や血管を構成する内皮細胞や平滑筋細胞の老化に伴う動的変化に着目して研究を進めています。特に血管の内皮機能が老化に伴って生じる影響を、その細胞膜上の糖脂質や糖タンパク質の機能的変化として捉え、炎症・再生に伴う血管リモデリングで起こる分子機構について解析を行っています。さらに、血管機能の変化が周辺細胞を介して組織機能にどの程度、またどのように影響を与えているかを検討しています。老化に伴う心血管病の発症から重症化に至る過程での心血管系の細胞間ネットワーク機構の解明を目指しています。
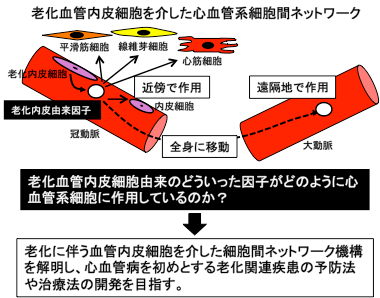
2.心臓の老化・疾患発症と組織機能再生に関する研究
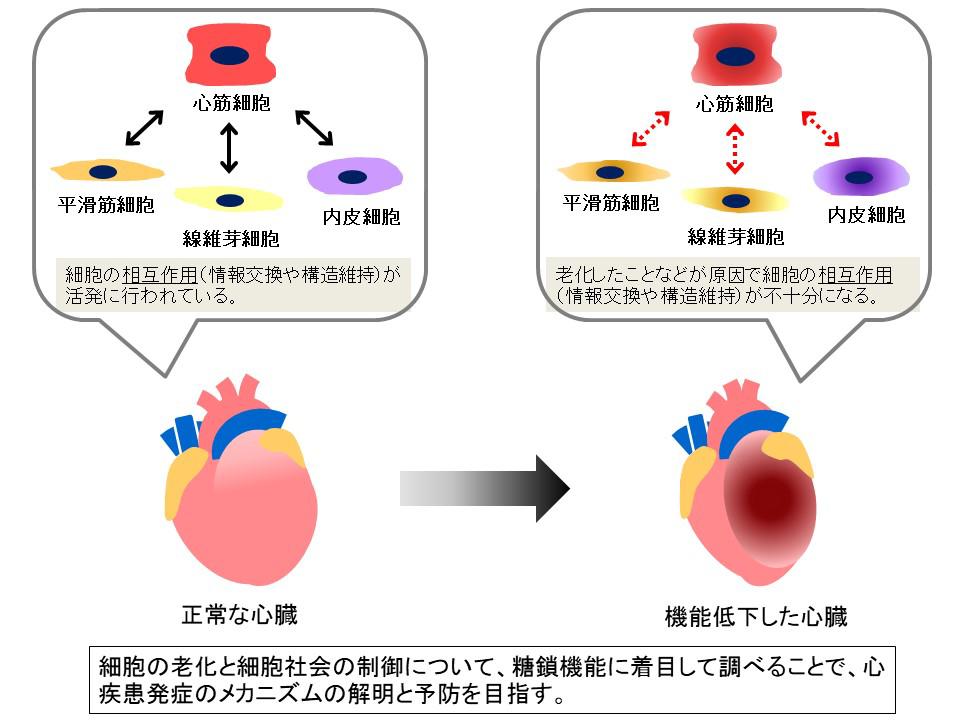
私たちの体は多種多様な細胞から構成され、生命が維持されている限りその「細胞社会」による統合的制御が続けられます。1つ1つの細胞は生き物であり、そこにも寿命があります。機能を果たせなくなった細胞は、多くの場合除去されます。そうすると個体の機能を維持するために直ちに修復が行われています。しかし、こうした修復を繰り返す中で、元の状態に戻るのに時間がかかったり、不十分だったりして、元の機能を維持できない「老化」がおこり、その蓄積が疾患へとつながっていくとも考えられています。
心臓組織も多くの種類の細胞で構成されています。ポンプ機能を果たす心臓の中で中心的に機能しているのは心筋細胞です。この心筋細胞は、ある時期より分裂・再生することなく一生涯働き続けると考えられています。その周囲では心筋細胞を補佐している線維芽細胞や血管由来の細胞により心臓は絶え間なく機能しています。この心筋細胞を軸とした多彩な細胞群が織りなす心機能が加齢とともにどのように役割を変え、組織としての機能が維持されているかを、様々な視点で解析しています。特に翻訳後修飾としてタンパク質に付加される糖鎖の機能に着目し、加齢に伴う変化とそれに伴う機能変化を通して、心臓を構成する細胞群が織りなす社会の制御機構を調べています。心血管疾患の発症のメカニズムの解明と予防につなげ、さらに、機能低下した心臓組織を再生させることに挑戦しています。
3.幹細胞研究:ヒト疾患モデル構築と再生医療に向けた基礎研究
増殖能と分化能を有する幹細胞(多能性幹細胞-ES細胞、iPS細胞-・様々な組織に存在する組織幹細胞-造血幹細胞、間葉系幹細胞、神経幹細胞など-)は、遺伝子・再生医療のソースとして、さらに難治性疾患に対する新たな疾患モデルの構築や創薬開発への応用が期待されています。すでに一部の疾患では幹細胞を利用した臨床応用が行われています。また近年では生体外でヒト組織様構造(ミニ臓器)の構築に向けた研究が著しい進展を見せています。一方で長時間経過によって起こる老化モデルは未だ確立したものはありません。私たちは幹細胞活用した老化モデルの構築による加齢性疾患の分子機序の解明を目指しています。高齢期の組織で疾患がどのように発症していくかを生体外で再現することによって、創薬や疾患発症の予防につながる研究基盤ができると考えています。
関連情報
研究所ホームページ「研究トピックス」(日本語)
日本語総説
- 佐々木紀彦、板倉陽子、豊田雅士.「老化関連疾患の予防、治療法の開発に向けた『老化と糖鎖』」,生化学会誌,90(5):719-723, 2018.
- 豊田雅士. 「血管の老化と慢性炎症」, 別冊BIO Clinica (北隆館), 10(2): 25-30, 2021.
- 佐々木紀彦. 「(カラーグラビア)老化と糖鎖研究」, 別冊BIO Clinica (北隆館), 10(2): 1-5, 2021.
- 佐々木紀彦. 「細胞老化と糖鎖」, 基礎老化研究誌(日本基礎老化学会), 46(1):23-31, 2022.
主要文献(英語論文)
- Miyata S, Saku N, Akiyama S, Javaregowda PK, Ite K, Takashima N, Toyoda M, Yura K, Kimura T, Nishina H, Nakazawa A, Kasahara M, Nonaka H, Kiyono T, Umezawa A. Puromycin-based purification of cells with high expression of the cytochrome P450 CYP3A4 gene from a patient with drug-induced liver injury (DILI). Stem Cell Res Ther, 13(1):6, 2022.
https://doi.org/10.1186/s13287-021-02680-4
- Nagai-Okatani C, Zou X, Matsuda A, Itakura Y, Toyoda M, Zhang Y, Kuno A. Tissue glycome mapping: lectin microarray-based differential glycomic analysis of formalin-fixed paraffin-embedded tissue sections. Methods Mol Biol, 2460:161-180, 2022. doi: 10.1007/978-1-0716-2148-6_10
- Ikemoto-Uezumi M, Zhou H, Kurosawa T, Yoshimoto Y, Toyoda M, Kanazawa N, Nakazawa T, Morita M, Tsuchida K, Uezumi A. Increased MFG-E8 at neuromascular junctions is an exacerbating factor for sarcopenia-associated denervation. Aging Cell, in press, 2021.https://doi.org/10.1111/acel.13536
- Sasaki N, Shinji S, Shichi Y, Ishiwata T, Arai T, Yamada T, Takahashi G, Ohta R, Sonoda H, Matsuda A, Iwai T, Takeda K, Yonaga K, Ueda K, Kuriyama S, Miyasaka T, Yoshida H. TGF-β1 increases cellular invasion of colorectal neuroendocrine carcinoma cell line through partial epithelial-mesenchymal transition. Biochem Biophys Rep. 30:101239, 2022.doi: 10.1016/j.bbrep.2022.101239
- Itakura Y, Sasaki N, Toyoda M. Glycan characteristics of human heart constituent cells maintaining organ function: relatively stable glycan profiles in cellular senescence. Biogerontology 22(6):623-637, 2021.doi: 10.1007/s10522-021-09940-z
研究所ホームページ「研究成果」(日本語)
板倉 陽子、「臓器としての機能を維持し続けるヒト心臓構成細胞の糖鎖の特徴は細胞が老化しても保持されている」2021.11.11
https://www.tmghig.jp/research/release/2021/1111.html
- Sasaki N, Itakura Y, Mohsin S, Ishigami T, Kubo H, Chiba Y. Cell Surface and Functional Features of Cortical Bone Stem Cells. Int J Mol Sci 22:11849, 2021.doi: 10.3390/ijms222111849
- Tsuneishi R, Saku N, Miyata S, Akiyama S, Javaregowda PK, Ite K, Takashima N, Toyoda M, Kimura T, Kuroda M, Nakazawa A, Kasahara M, Nonaka H, Kamiya A, Kiyono T, Yamauchi J, Umezawa A. Ammonia-based enrichment and long-term propagation of zone I hepatocyte-like cells. Sci Rep 11(1):11381, 2021.doi: 10.1038/s41598-021-90708-3
- Sasaki N, Toyoda M, Ishiwata T. Gangliosides as signaling regulators in cancer. Int J Mol Sci 22(10):5076, 2021. (Review)doi: 10.3390/ijms22105076
- Minami F, Sasaki N, Shichi Y, Gomi F, Michishita M, Ohkusu-Tsukada K, Toyoda M, Takahashi K, Ishiwata T. Morphofunctional analysis of human pancreatic cancer cell lines in 2- and 3-dimensional cultures. Sci Rep, 11:7665, 2021.https://doi.org/10.1038/s41598-021-86028-1
- Gomi F, Sasaki N, Shich Y, Minami F, Shinji S, Toyoda M, Ishiwata T. Polyvinyl alcohol increased growth, migration, invasion, and sphere size in the PK-8 pancreatic ductal adenocarcinoma cell line. Heliyon, 7(2):e06182, 2021.doi: 10.1016/j.heliyon.2021.e06182
- Kurosawa T, Goto M, Kaji N, Akiyo S Mihara T, Ikemoto-Uezumi M, Toyoda M, Kanazawa N, Nakazawa T, Hori M, Uezumi A. Liver fibrosis-induced muscle atrophy is mediated by elevated levels of circulating TNFα. Cell Death Dis, 12(1):11, 2021.doi: 10.1038/s41419-020-03353-5
- Uezumi A, Ikemoto-Uezumi M, Zhou H, Kurosawa T, Yoshimoto Y, Nakatani M, Hitachi K, Yamagushi H, Watkatsuki S, Araki T, Morita M, Yamada H, Toyoda M, Kanazawa N, Nakazawa T, Hino J, Fukada S, Tsuchida K. Mesenchymally expressed Bmp3b maintains skeletal muscle integrity and reduction of its expression contributes to sarcopenia. J Ciin Investig, 131(1):e139617, 2021. doi: 10.1172/JCI139617.
- Sasaki N, Gomi F, Yoshimura H, Yamamoto M, Matsuda Y, Michishita M, Hatakeyama H, Kawano Y, Toyoda M, Korc M, Ishiwata T. FGFR4 Inhibitor BLU9931 attenuates pancreatic cancer cell proliferation and invasion while inducing senescence: evidence for senolytic therapy potential in pancreatic cancer. Cancers (Basel), 12(10):E2976, 2020.doi: 10.3390/cancers12102976.
- Nishiwaki M, Toyoda M, Oishi Y, Ishida S, Horiuchi SI, Makino-Itou H, Kimura T, Ohno SI, Ohkura T, Enosawa S, Akutsu H, Nakazawa A, Kasahara M, Kiyono T, Umezawa A. Immortalization of human hepatocytes from biliary atresia with CDK4R24C, cyclin D1, and TERT for cytochrome P450 induction testing. Sci Rep, 10(1):17503, 2020.doi: 10.1038/s41598-020-73992-3.
- Kanzaki S, Toyoda M, Umezawa A, Ogawa K. Application of mesenchymal stem cell therapy and inner ear regeneration for hearing loss: a review. Int J Mol Sci, 21(16):5764, 2020.https://doi.org/10.3390/ijms21165764
- Ikemoto Y, Miyashita T, Nasu M, Hatsune H, Kajiwara K, Fujii K, Motojima T, Kokido I, Toyoda M, Umezawa A. Gorlin syndrome-induced pluripotent stem cells form medulloblastoma with loss of heterozygosity in PTCH1. Aging (Albany NY), 12(10):9935-9947, 2020.doi: 10.18632/aging.103258
- Kosugi M, Otani M, Kikkawa Y, Itakura Y, Sakai K, Ito T, Toyoda M, Sekita Y, Kimura T. Mutations of histone demethylase genes encoded by X and Y chromosomes, Kdm5c and Kdm5d, leads to noncompaction cardiomyopathy in mice. Biochem Biophys Res Commun, 525(1):100-106, 2020. https://doi.org/10.1016/j.bbrc.2020.02.043
- Sasaki N, Itakura Y, Toyoda M. Rapamycin promotes endothelial-mesenchymal transition during stress-induced premature senescence through the activation of autophagy. Cell Commun Signal, 18(1):43, 2020.doi: 10.1186/s12964-020-00533-w
研究所ホームページ「研究成果」(日本語)
佐々木紀彦、「ラパマイシンは、内皮細胞のストレス誘導性老化の過程において、オートファジーの活性化を介して内皮間葉転換を促進させる」https://www.tmghig.jp/research/release/2020/0313.html
- Sasaki N, Toyoda M. Vascular diseases and gangliosides. Int J Mol Sci, 20(24), E6362, 2019. (Review)doi: 10.3390/ijms20246362
- Sasaki N, Hirabayashi K, Michishita M, Takahashi K, Hasegawa F, Gomi F, Itakura Y, Nakamura N, Toyoda M, Ishiwata T. Ganglioside GM2, highly expressed in the MIA PaCa-2 pancreatic ductal adenocarcinoma cell line, is correlated with growth, invasion, and advanced stage. Sci Rep, 9(1):19369, 2019.doi: 10.1038/s41598-019-55867-4
- Sasaki N, Gomi F, Hasegawa F, Hirano K, Fujiwara M, Toyoda M, Ishiwata T. Characterization of the metastatic potential of the floating cell component of MIA PaCa-2, a human pancreatic cancer cell line. Biochem Biophys Res Commun, 522(4):881-888, 2020.doi: 10.1016/j.bbrc.2019.11.120.
- Shichi Y, Sasaki N, Michishita M, Hasegawa F, Matsuda Y, Arai T, Gomi F, Aida J, Takubo K, Toyoda M, Yoshimura H, Takahashi K, Ishiwata T. Enhanced morphological and functional differences of pancreatic cancer with epithelial or mesenchymal characteristics in 3D culture. Sci Rep, 9(1):10871, 2019.doi: 10.1038/s41598-019-47416-w
- Sasaki N, Itakura Y, Gomi F, Hirano K, Toyoda M, Ishiwata T. Comparison of functional glycans between cancer stem cells and normal stem cells. Histol Histopathol, 34(9):995-1007, 2019. (Review).doi: 10.1007/978-981-13-8023-5_4
- Aoto S, Katagiri S, Wang Y, Pagnamenta AT, Sakamoto-Abutani R, Toyoda M, Umezawa A, Okamura K. Frequent retrotransposition of endogenous genes in ERCC2-deficient cells derived from a patient with xeroderma pigmentosum. Stem Cell Res Ther, 10(1):273, 2019. doi: 10.1186/s13287-019-1381-z.
- Sasaki N, Toyoda M, Hasegawa F, Fujiwara M, Gomi F, Ishiwata T. Fetal bovine serum enlarges the size of human pancreatic cancer spheres accompanied by an increase in the expression of cancer stem cell markers. Biochem Biophys Res Commun, 514(1):112-117, 2019. doi: 10.1016/j.bbrc.2019.04.117.
- Sasaki N, Itakura Y, Toyoda M. Gangliosides contribute to vascular insulin resistance. Int J Mol Sci, 20(8):1819, 2019. (Review)https://doi.org/10.3390/ijms20081819
- Sasaki N, Toyoda M, Yoshimura H, Matsuda Y, Arai T, Takubo K, Aida J, Ishiwata T. H19 long non-coding RNA contributes to sphere formation and invasion through regulation of CD24 and integrin expression in pancreatic cancer cells. Oncotarget, 9(78):34719-34734, 2018.https://doi.org/10.18632/oncotarget.26176
- Iso Y, Usui S, Toyoda M, Spees JL, Umezawa A, Suzuki H. Bone marrow-derived mesenchymal stem cells inhibit vascular smooth muscle cell proliferation and neointimal hyperplasia after arterial injury in rats. Biochem Biophys Rep,16:79-87, 2018.https://doi.org/10.1016/j.bbrep.2018.10.001
- Nishino K, Arai Y, Takasawa K, Toyoda M, Yamazaki-Inoue M, Sugawara T, Akutsu H, Nishimura K, Ohtaka M, Nakanishi M, Umezawa A. Epigenetic-scale comparison of human iPSCs generated by retrovirus, Sendai virus or episomal vectors. Regenerative Therapy, 9:71-78, 2018.https://doi.org/10.1016/j.reth.2018.08.002
- Itakura Y, Sasaki N, Toyoda M. Qualitative and quantitative alterations in intracellular and membrane glycoproteins maintain the balance between cellular senescence and human aging. Aging (Albany NY), 10(8):2190-2208, 2018.https://doi.org/10.18632/aging.101540
- Miura Y, Hashii N, Ohta Y, Itakura Y, Tsumoto H, Suzuki J, Takakura D, Abe Y, Arai Y, Toyoda M, Kawasaki N, Hirose N, Endo T. Characteristic glycopeptides associated with extreme human longevity identified through plasma glycoproteomics. Biochim Biophys Acta, 1862(6):1462-1471, 2018.https://www.sciencedirect.com/science/article/pii/S0304416518300874?via%3Dihub
- Sasaki N, Ishiwata T, Hasegawa F, Michishita M, Kawai H, Matsuda Y, Arai T, Ishikawa N, Aida J, Takubo K, Toyoda M. Stemness and anti-cancer drug resistance in ABCG2 highly expressed pancreatic cancer is induced on 3D-culture condition. Cancer Sci, 109(4):1135-1146, 2018.https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5891171/
- Takasawa K, Arai Y, Yamazaki-Inoue M, Toyoda M, Akutsu H, Umezawa A, Nishino K. DNA hypermethylation enhanced telomerase reverse transcriptase expression in human induced stem cells. Human Cell, 31(1):78-86, 2018.https://link.springer.com/article/10.1007%2Fs13577-017-0190-x
- Sasaki N, Itakura Y, Toyoda M. Ganglioside GM1 contributes to extracellular/intracellular regulation of insulin resistance, impairment of insulin signaling and down-stream eNOS activation, in human aortic endothelial cells after short- or long-term exposure to TNFα. Oncotarget, 9(5):5562-5577, 2018.http://www.oncotarget.com/index.php?journal=oncotarget&page=article&op=view&path%5B%5D=23726
- Sasaki N, Itakura Y, Toyoda M. Sialylation regulates myofibroblast differentiation of human skin fibroblasts. Stem Cell Res Ther, 8(1):81, 2017.https://www.ncbi.nlm.nih.gov/labs/articles/28420408/
- Zou X, Yoshida M, Nagai-Okatani C, Iwaki J, Matsuda A, Tan B, Hagiwara K, Sato T, Itakura Y, Noro E, Kaji H, Toyoda M, Zhang Y, Narimatsu H, Kuno A. A standardized method for lectin microarray-based tissue glycome mapping. Sci Rep, 7:43560, 2017.https://www.nature.com/articles/srep43560
- Seko Y, Azuma N, Yokoi T, Kami D, Ishii R, Nishina S, Toyoda M, Shimokawa H, Umezawa A. Anteroposterior patterning of gene expression in the human infant sclera:chondrogenic potential and wnt signaling. Cur Eye Res, 42(1):145-154, 2017.http://www.tandfonline.com/doi/full/10.3109/02713683.2016.1143015
- Tateno H, Saito S, Hiemori K, Kiyoi K, Hasehira K, Toyoda M, Onuma Y, Ito Y, Akutsu H, Hirabayashi J. α2-6sialylation is a marker of the differentiation potential of human mesenchymal stem cells. Glycobiology, 26(12):1328-1337, 2016.https://academic.oup.com/glycob/article-lookup/doi/10.1093/glycob/cww039
- Tone H, Yoshioka S, Akiyama H, Nishimura A, Ichimura M, Nakatani M, Kiyono T, Toyoda M, Watanabe M, Umezawa A. Embryoid body-explant outgrowth cultivation from induced-plulipotent stem cells (iPSCs) in an automated closed platform. BioMed Res Int, 2016:7098987, 2016.https://www.hindawi.com/journals/bmri/2016/7098987/
- Okamura K, Sakaguchi H, Sakamoto-Abutani R, Nakanishi M, Nishimura K, Yamazaki-Inoue M, Ohtaka M, Periasamy VS, Alshatwi AA, Higuchi A, Hanamoka K, Nakabayashi K, Takada S, Hata K, Toyoda M, Umezawa A. Distinctive features of single nucleotide alterations in induced pluripotent stem cells with different types of DNA repair deficiency disorders. Sci Rep, 6:26342, 2016.http://www.nature.com/articles/srep26342
- Komuta Y, Ishii T, Kaneda M, Ueda Y, Miyamoto K, Toyoda M, Umezawa A, Seko Y. In vitro transdifferentiation of human peripheral blood mononuclear cells to photoreceptor-like cells. Biol Open,5(6):709-719, 2016.http://bio.biologists.org/content/5/6/709.long
- Itakura Y, Sasaki N, Kami D, Gojo S, Umezawa A, Toyoda M. N- and O-glycan cell surface protein modifications associated with cellular senescence and human aging. Cell Biosci, 6:14, 2016.http://cellandbioscience.biomedcentral.com/articles/10.1186/s13578-016-0079-5
- Kitajima K, Nakajima M, Kanokoda M, kyba M, Dandaoat A, Tolar J, Saito MK, Toyoda M, Umezawa A, Hara T. GSK3β inhibition activates the CDX/HOX pathway and promotes hemogenic endothelial progenitor differentiation from human pluripotent stem cells. Exp Hematol, 44(1):68-74, e1-10, 2016.http://www.sciencedirect.com/science/article/pii/S0301472X15006748
- Okamura K, Toyoda M, Hata K, Nakabayashi K, Umezawa A. Whole-exome sequencing of fibroblast and its iPS cell lines derived from a patient diagnosed with xeroderma pigmentosum. Genom Data, 6:4-6, 2015.http://www.sciencedirect.com/science/article/pii/S221359601500152X
- Ojima T, Shibata E, Saito S, Toyoda M, Nakajima H, Yamazaki-Inoue M, Miyagawa Y, Kiyokawa N, Fujimoto J, Sato T, Umezawa A. Glycolipid dynamics in generation and differentiation of induced pluripotent stem cells. Sci Rep, 5:14988, 2015.http://www.nature.com/articles/srep14988
- Sasaki N, Itakura Y, Toyoda M. Ganglioside GM1 contributes to the state of insulin resistance in senescent human arterial endothelial cells. J Biol Chem, 290:25475-25486, 2015.http://www.jbc.org/content/290/42/25475.long http://biomedfrontiers.org/diabetes-obesity-2016-12/
- Kawasaki T, Kirita Y, Kami D, Kitani T, Ozaki C, Itakura Y, Toyoda M, Gojo S. Novel detergent for whole organ tissue engineering. J Biomed Mater Res A,103(10):3364-3373, 2015.http://onlinelibrary.wiley.com/doi/10.1002/jbm.a.35474/abstract
- Watada Y, Yamashita D, Toyoda M, Tsuchiya K, Hida N, Tanimoto A, Ogawa K, Kanzaki S, Umezawa A. Magnetic response monitoring of superparamagnetic iron oxide (SPIO)-labeled stem cells transplanted into the inner ear. Neurosci Res, 95;21-26, 2015.http://www.sciencedirect.com/science/article/pii/S0168010215000280

